研究グループ紹介
タンパク質科学(教授 戸澤 譲、助教 高橋 拓子)
1.研究内容
セントラルドグマの最終ステップでは、メッセンジャーRNAの核酸配列をアミノ酸配列に翻訳してタンパク質が合成されます。生物では様々な構造と機能をもつタンパク質が複雑に関係し合って生命活動が成り立っています。当研究室では膜タンパク質など作ることが難しいタンパク質を中心に、生命現象におけるその機能を明らかにし、さらにその機能を応用研究につなげることを目指して研究を進めています。具体的な研究手法としては、試験管内転写・翻訳技術を駆使して合成したタンパク質の働きを分子レベルで解明し、さらにそのタンパク質の生体内での働きを調べるために、微生物や植物の遺伝子組換え実験を行ないます。
2.最近の研究テーマ
- 植物タンパク質合成系の解明を目指す分子生物学
- バクテリアの膜ストレス応答機構の解明
- 応用を目指す:有用酵素タンパク質の機能解析および機能改変
- 難題の克服に挑戦する:機能を持つ膜タンパク質の試験管内再構成
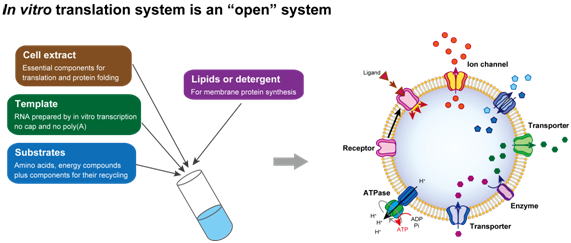 |
| 図1:試験管内タンパク質合成系は、open systemであるため、様々な改良を加えることができます。その一例が膜環境を加えることによる膜タンパク質の合成です。これまでに様々な膜輸送タンパク質や膜結合型酵素について、機能を持つ形でのタンパク質の合成に成功してきました。 |
植物糖鎖生物学(教授 小竹 敬久、助教 高橋 大輔)
1.研究内容
ブドウ糖(グルコース)をはじめとする糖質は細胞、組織の構築材料やエネルギー源として機能していることが知られています。単糖が連なってできる高分子成分は糖鎖と呼ばれます。すべての細胞は糖鎖を含んだ細胞膜や細胞間物質に囲まれて生命活動を営んでおり、糖鎖は細胞の認識と相互作用に深く関わっています。糖鎖生物学 (Glycobiology)は、糖鎖の様々な生物情報を解明し、生物学の新しい知識として取り入れていく学問分野です。当研究室では、植物細胞壁多糖類の合成と分解、構造に関する生化学的な研究を進めています。また、凍結ストレスをはじめとした環境ストレスに細胞壁がどのように応答しているのかにも着目して研究しています。
2.最近の研究テーマ
- アラビノガラクタンプロテインの合成酵素と分解酵素
- 糖ヌクレオチド代謝酵素
- イネやオオムギの細胞壁突然変異体
- 低温・凍結ストレス適応機構に関与する細胞壁構成成分の解析
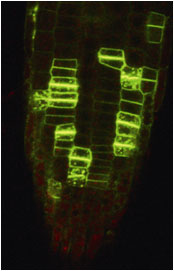 |
 |
| 図1:細胞板に局在する植物のプロテオグリカン、AGP | 図2:イネ節間(茎)の発達した二次細胞壁(教育学部・金子康子先生撮影) |
生物元素化学(教授 藤城 貴史 )
1.研究内容
生物はどのようにして生まれたのでしょうか?生物の起源に関する問いは、古くから多くの科学者の興味を引きつけてきました。生物を有機体として考えると、その構成成分はタンパク質や糖、脂質などが主であり、その構成元素である炭素、水素、酸素、窒素などの典型元素の割合は99.9%にも達します。しかし実際には、多くの生物は、これらの典型元素のみでの生命活動の維持は困難です。残りの0.1%である遷移金属や半金属のような生体微量元素が、典型元素のみで成し得ない高難度な化学反応を実現することで、初めて生物は多種多様な代謝が可能となります。当研究室では、生物が遷移金属や半金属元素を酵素や補酵素に組み込む生合成の仕組みや、それら生体微量元素を含む分子の特異な構造や反応ついて、有機化学、無機化学、構造生物学の手法を用いて研究を行なっています。これらの研究により、生命進化の過程において微量元素が果たした役割の理解を進めるとともに、生物の微量元素の利用法に倣った有用な触媒やナノマテリアルの開発にも取り組んでいます。
2.最近の研究テーマ
- 特殊な金属クラスター含有酵素とその関連酵素群の研究
- Ni含有補因子の生合成酵素群の研究
- 金属ポルフィリン型の補因子の生合成酵素群の研究
- 重元素を含むアミノ酸代謝系の"ビタミンB6誘導体"="PLP"依存型酵素群の研究
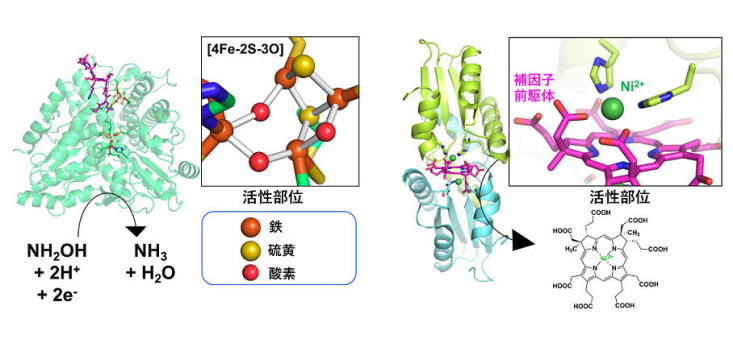 |
| 図1:当研究室が立体構造を明らかとした遷移金属が関係する代謝系酵素の例. (左)[4Fe-2S-3O]クラスターを持つ大腸菌由来の酵素. (右)Niを含む補因子を生合成するメタン生成古細菌由来の酵素. |
細胞生化学(講師 是枝 晋)
1.研究内容
植物は地球上の様々な環境に適応して、効率の良い光合成のやり方を進化させてきました。その中でも当研究室では、低二酸化炭素濃度と高温に適応したC4光合成と、乾燥に適応した多肉植物型酸代謝(CAM)の仕組みを、細胞小器官のレベルで調べています。例えば、乾燥地域のCAM植物は、乾燥ストレスと同時に、常に直射日光の当たる強光ストレスにもさらされています。このような複合的ストレスに対しどのようにして耐性を得ているのか、特に葉緑体の光合成調節機構の面から明らかにしようとしています。また、葉緑体や液胞のような細胞小器官は、様々な代謝産物を細胞質とやりとりするために、それぞれの代謝産物に特異的な輸送体をもっています。C4植物やCAM植物の葉緑体や液胞は、C3植物とは異なった輸送活性をもっていることがわかっていますが、それらのうちいくつかは輸送体が分子レベルでは同定されていません。これらの輸送体を同定し、さらに、どのような仕組みで調節が行われているか明らかにすることを目指しています。
2.最近の研究テーマ
- 誘導型CAM植物(アイスプラント)の葉緑体での光合成産物輸送の仕組み
- CAM植物葉緑体の強光耐性の仕組み
- CAM植物の液胞膜リンゴ酸輸送体の同定
- C4植物葉肉細胞葉緑体のピルビン酸輸送の仕組み
 |
| 図1:アイスプラントは塩濃度が高いとC3光合成からCAMに切り替わる |
 |
| 図2:C4植物は2種類の光合成細胞を持つ C4植物・キビ(Panicum miliaceum)の葉を酵素で消化し得た2種類の光合成細胞(左:葉肉細胞、右維管束鞘細胞)。C4光合成はこれらの細胞の分担作業で成り立っており、それぞれの細胞の役割に応じて、持っている葉緑体の機能も異なる。 |
環境応答(教授 西山 佳孝、助教 神保 晴彦)
1.研究内容
光合成生物は、刻々と変動する環境のなかで生命活動を維持するために、さまざまな適応手段を発達させています。光が強いときや弱いとき、温度が上がったり下がったりするときに、その環境に合わせて光合成機能を最適化するとともに、環境変化によって生じるストレス傷害を回避する機構がはたらきます。そのために光合成生物は、環境の変化を検知し、その情報を伝達して、特定の遺伝子の発現を転写レベル、翻訳および翻訳後レベルで高度に制御しています。当研究室では、シアノバクテリアという光合成生物を用いて、環境応答に関わる遺伝子の発現調節のメカニズムや遺伝子産物の機能を研究しています。
2.最近の研究テーマ
- 光合成の強光ストレス応答
- タンパク質合成系のレドックス制御機構
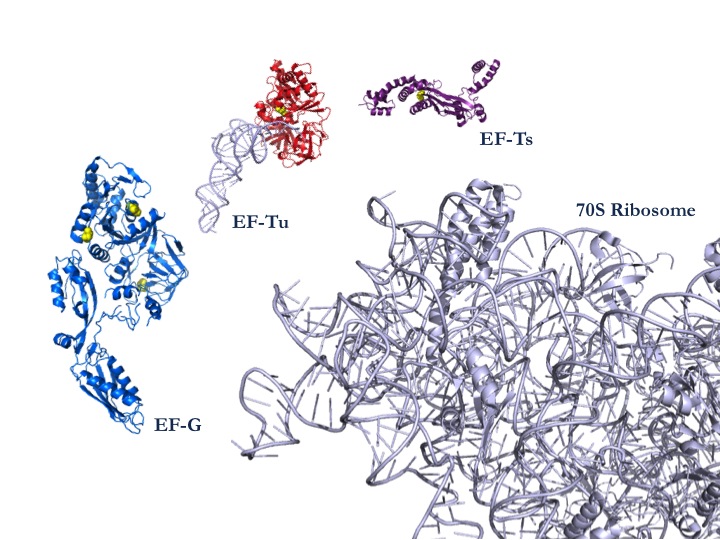 |
| 図1:タンパク質合成系を構成する70Sリボソームと翻訳因子の一部。このうち翻訳因子EF-Gが活性酸素の標的となり、タンパク質合成や光合成の機能低下に結びつくことがわかった。 |
遺伝子発現制御(教授 日原 由香子、准教授 高橋 朋子)
1.研究内容
光合成生物が環境変動をどのように感じ取っているのか、細胞内でどのようなシグナル伝達が行われているのか、その結果として遺伝子発現やタンパク質の活性がどのように調節されて光合成複合体や各種代謝反応の順化応答が実現されるのか、葉緑体の祖先生物であるシアノバクテリアを用いて、分子レベルでのメカニズム解明を目指しています。これまでに同定した調節因子のいくつかは、光合成複合体の形成や糖・脂質などの代謝制御に重要な役割を担っていることが明らかになり、そこから有用物質生産を目指した代謝改変などの応用研究も展開しているところです。
高橋助教は、ウイルスが感染したヒト細胞におけるノンコーディングRNAの機能解明を目指しています。今後、共同研究により、シアノバクテリアのノンコーディングRNA研究も展開していきたいと考えています。
2.最近の研究テーマ
- 環境順化応答に働く調節因子の機能解明
- 代謝制御に関与する転写因子の機能解析とその応用展開
- シアノバクテリアにおける油脂蓄積プロジェクト
- ウイルスが感染したヒト細胞におけるノンコーディングRNAの機能解明
- シアノバクテリアのノンコーディングRNAの機能解明
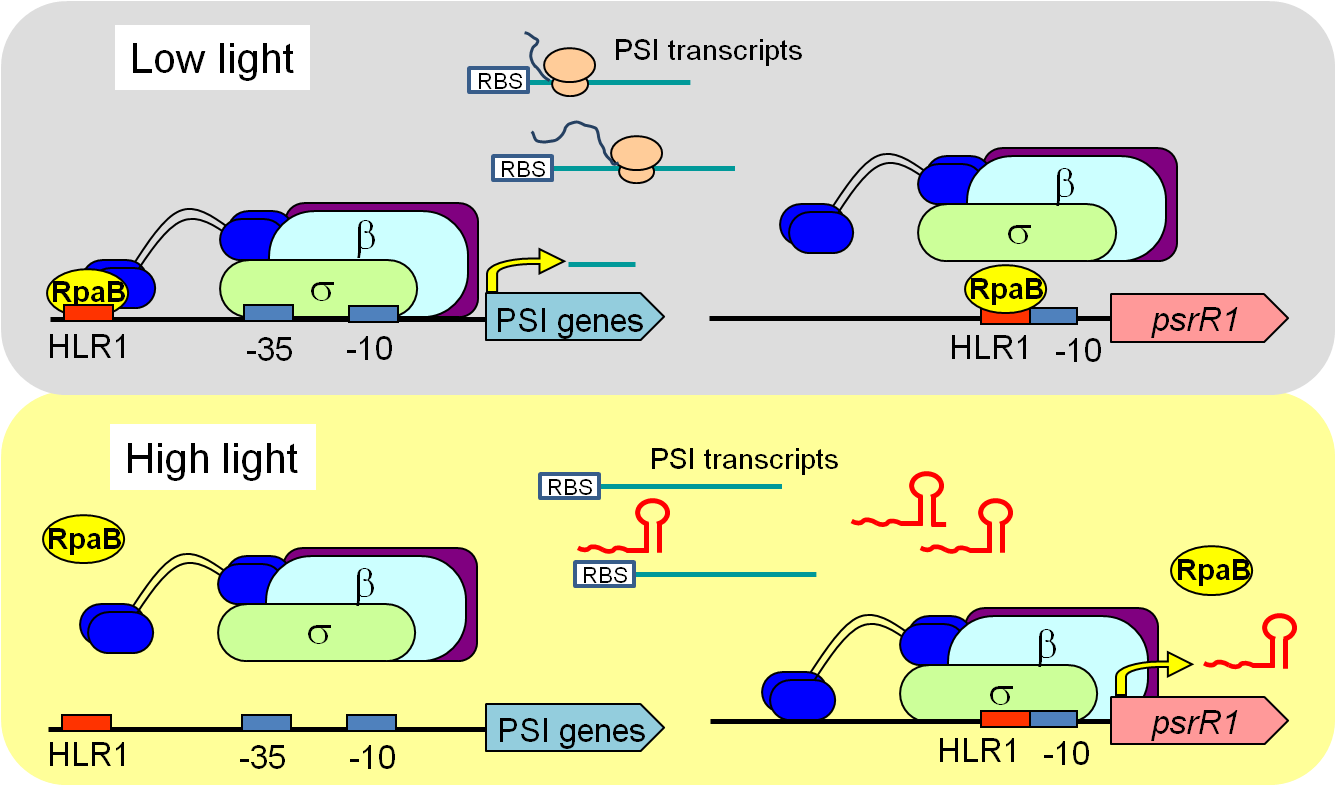 |
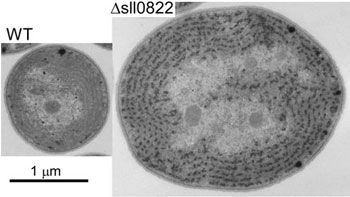 |
| 図1:光化学系Ⅰ遺伝子群が弱光下で転写活性化され、強光下では発現抑制される制御メカニズム。転写因子とsRNAが二重に働くことにより、厳密な制御が可能となっている。 | 図2:シアノバクテリアの転写制御因子の一つを欠損した株(Δsll0822)では、野生株(WT)に比べて細胞サイズが著しく大きくなった(教育学部・金子康子先生撮影)。 |
 |
 |
| 図3:ヒトにおける抗ウイルス生体防御機構。RNAによる免疫の解明と制御を目指している。 | 図4:ウイルスが感染した細胞の免疫応答はRNAサイレンシングを介して制御される。 |
細胞情報(教授 豊田 正嗣、助教 須田 啓)
1.研究内容
神経を持たない植物は、どのようにして自分が傷つけられたことを感受して、その情報を全身へ伝えるのでしょうか?内耳の耳石器官を持たない植物は、どのようにして重力を感じるのでしょうか?ハエトリソウやオジギソウは、なぜ触れると葉を瞬時に閉じるのでしょうか? 細胞情報研究室では、傷害・重力・接触といった”力”と”生物”の関係(メカノバイオロジー)を研究しています。植物が”力”を感受する瞬間を可視化するために、広視野蛍光顕微鏡・二光子共焦点顕微鏡・ポータブル蛍光顕微鏡・三次元イメージングなどの新しいイメージング技術を開発し、植物独自の高速情報伝達機構を明らかにしたいと考えています。
2.最近の研究テーマ
- 植物-昆虫間相互作用の研究
- 揮発性物質を介した植物-植物間コミュニケーションの研究
- ハエトリソウやオジギソウの高速接触応答の研究
 |
 |
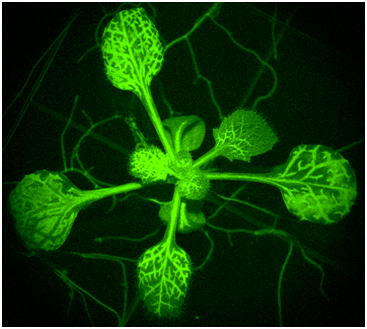
| 図1:植物の長距離・高速シグナルの可視化 | 図2:ハエトリソウ(上段)とオジギソウ(下段; 萩原&豊田, 日本生態学会誌, 2024) の接触応答性高速運動 |
植物環境科学(教授 川合真紀、准教授 石川 寿樹)
1.研究内容
近年、人類の活動による大規模な地球環境の破壊や、急激な人口増加による食料不足が大きな問題となっています。私達は、植物と環境との関わり合いを科学的に解明し、得られた知見を基に、不良環境でも生育可能な植物の分子育種や、高い二酸化炭素吸収能力を有する高バイオマス生産植物の育種へと結びつく基盤研究を行っています。例えば、植物の環境応答として、細胞膜脂質やオルガネラの機能を維持する分子機構の解明を行っています。また、植物に特異的なエネルギー、物質生産器官である葉緑体の代謝改変によって、強光ストレスに強く物質生産能力の優れた作物を開発するための基礎研究も進めています。他にも、植物の生長過程で働く転写因子に注目し、二次細胞壁形成の制御因子の機能解析を進めています。
2.最近の研究テーマ
- 植物のエネルギー代謝の改変による光合成・物質代謝の研究
- 環境ストレス耐性機構の解明とストレス耐性植物の作出
- 植物の物理的強度獲得機構の解明
- 転写因子複合体の生理的役割の解明
- スフィンゴ脂質による植物生体膜機能制御機構の解明と代謝工学的機能改変
 |
 |
 |
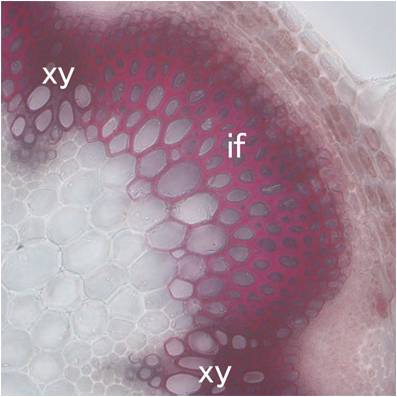
| 図1:シロイヌナズナの遺伝子欠損株。葉緑体でNADPを合成するNADキナーゼが欠損すると、葉が黄化して光合成が異常になる。左が野生型、右が変異体。 | 図2:シロイヌナズナの花茎の横断切片。二次細胞壁を形成する道管要素(xy)や繊維細胞(if)が、赤く染色されている。 | 図3:代謝物網羅解析(メタボロミクス)。質量分析により、光合成や窒素同化、生体膜形成などに関わる多種多様な代謝産物を網羅的に定量解析できる。 |
分子微生物学(准教授 大塚 裕一)
1.研究内容
地球上で最も豊富なウイルスであるバクテリオファージ(ファージ)は、食物連鎖の最下層に位置する細菌の密度に大きな影響を与えます。両者の攻防は30億年前から始まったと推定されており、細菌はファージ感染を回避するために外膜の形状を変化させたり、増殖を阻害するために制限酵素やCRISPR機構を獲得する等、さまざまな抗ファージ機構を発達させてきました。一方、ファージもこれらの機構に対抗するために新たな仕組みを常に獲得してきました。したがって、両者は共進化の過程にあり、各々の生存戦略が互いの進化を促進してきました。当研究室では、両者の生存戦略や遺伝子発現機構を分子レベルで理解すること、そしてその成果を病原性細菌や近年問題になっている薬剤耐性菌を抑える対策へ応用する研究に取り組みます。
2.最近の研究テーマ
- トキシン-アンチトキシン系をめぐる細菌とファージの攻防
- 遺伝子の水平伝播に対するトキシン-アンチトキシン系の関与
- トキシン-アンチトキシン系を利用した抗菌ペプチドの探索
- 細菌とファージの遺伝子発現機構
- ファージの宿主認識機構
 |
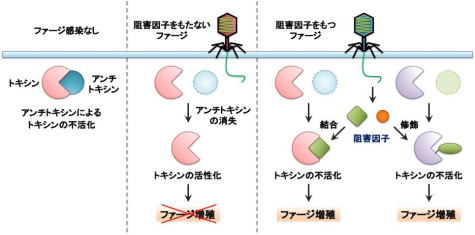 |
| 図1:T4ファージのプラーク | 図2:トキシン-アンチトキシン系をめぐる細菌とファージの攻防:トキシン-アンチトキシン系による抗ファージ作用(真ん中)と抗ファージ作用に対抗する様々なファージの仕組み(右側) |
微生物脂質科学(准教授 松岡 聡)
1.研究内容
私たちのグループでは、細菌細胞表層(脂質生体膜・ペプチドグリカン細胞壁)の構造と細胞の複製、その複製に働く酵素タンパク質の性質と機能、DNA複製開始や遺伝情報発現の生体膜構造による制御の仕組みなどを、分子レベルで解明することを目的として研究を進めています。生命にとって基本的な課題を研究するのに適した材料である枯草菌と大腸菌を用いています。
2.最近の研究テーマ
- 枯草菌糖脂質の生理機能の解明
- 細菌の細胞形態に関わる細胞表層構造についての研究
- 脂質欠損によって活性化する大腸菌二成分制御系の解析
- 枯草菌ECFシグマ因子の活性化機構の解析
- 脂質組成改変による機能性納豆菌の試み
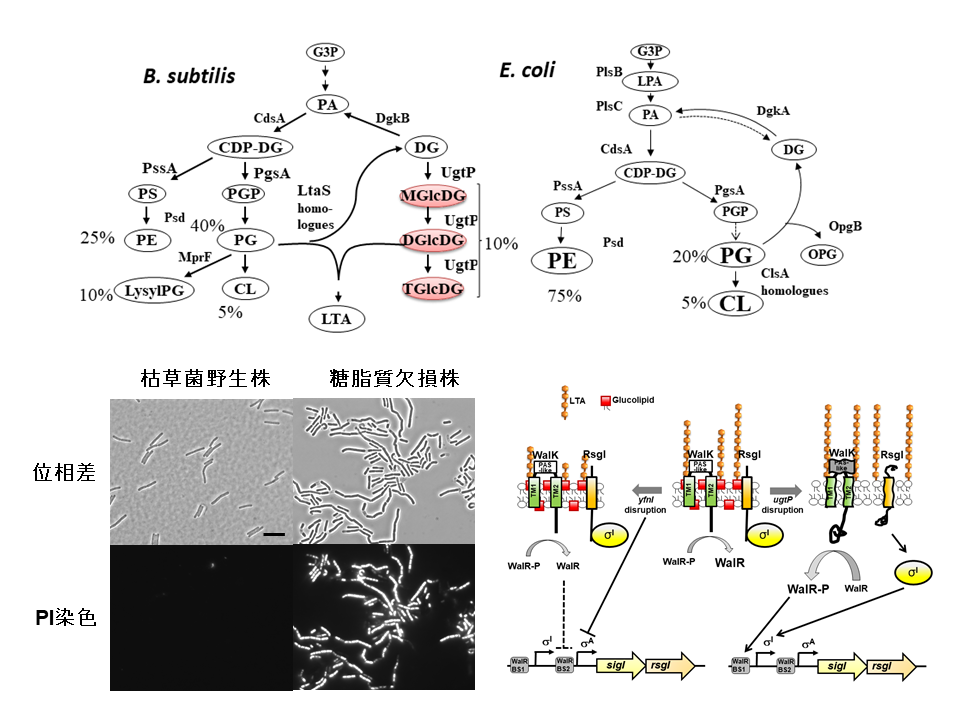 |
| 上図:枯草菌(B. subtilis)と大腸菌(E. coli)の脂質生合成経路。左下図:枯草菌糖脂質欠損株における膜透過性の変化。糖脂質欠損株では、通常細胞膜を透過しないヨウ化プロピジウム(PI)が細胞膜を透過する。右下図:枯草菌の細胞表層の変化における遺伝子発現制御のモデル図。 |
植物制御化学(准教授 米山 香織)
1.研究内容
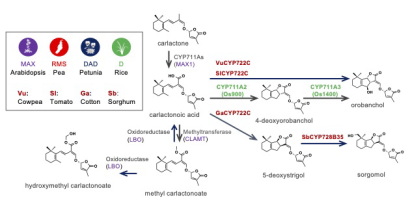
植物の根から分泌され、根寄生植物やアーバスキュラー菌根菌の宿主認識シグナルとして作用するストリゴラクトンは、植物体内では地上部および地下部の形態形成を制御する最も新しい植物ホルモンとして知られています。多機能なストリゴラクトンは、植物によって生合成される構造が異なり、これまで30種類以上のストリゴラクトンが単離構造決定されました。私たちの研究室では、これら多様なストリゴラクトンが植物体内でどのように生合成され、分泌されるのか。またその生合成・分泌はどのようにして制御されているのかを解明しようとしています。
2.最近の研究テーマ
- 陸上植物におけるストリゴラクトン生合成およびその調節機構の解明
- 植物-植物コミュニケーションにおけるストリゴラクトンの機能解析
- 強害根寄生雑草の自殺発芽誘導活性物質に関する研究
 |
 |
| 図1:様々な植物で明らかになってきたストリゴラクトンの生合成 経路と化学構造 |
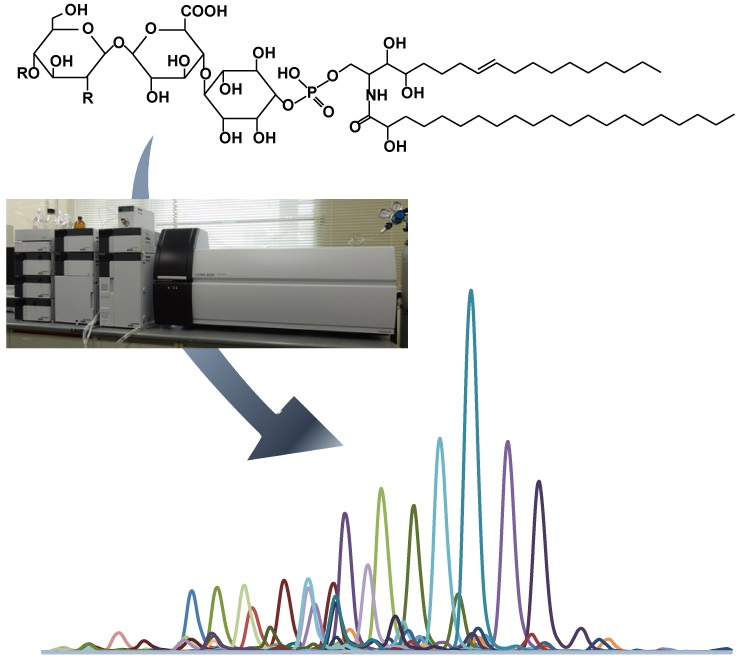
図2:微量にしか生産されないストリゴラクトンを 高感度で検出できるLC-MS/MS |